肝硬化患者行腹腔镜胆囊切除术的病例选择与策略
背景
胆囊切除术是当今世界最常见的腹部手术,在美国每年的手术量超过750 000例[1]。患者的合并症会增加腹腔镜和OC的资源消耗[2]。影响胆囊切除术并发症和死亡率的主要因素之一是肝硬化。尽管胆囊切除术、脐疝和腹股沟疝修补术已被证明是肝硬化患者最安全的非肝脏手术,但恰当的患者选择对于获得良好的结果至关重要[3]。肝硬化患者胆石症的发病率高于一般人群,据报道,分别为9.5%~13.7%和5.2%[4,5]。尸检记录中胆结石的患病率在肝硬化患者中从29.4%到46%不等,而在没有肝病的患者中约为13%[6,7]。发病率较高的原因包括:胆汁盐生成减少、肝硬化患者雌激素水平增加、胆囊运动、排空减少,以及非结合胆红素水平升高这些由血管内溶血和胆囊功能改变引起的结果[8]。
过去,OC是治疗需要行胆囊切除术患者的标准方法。然而,LC已被证实在非肝硬化患者治疗中,有着比OC恢复更快和住院时间更短的显著优势[9]。因此,LC成为大多数胆囊切除术的标准治疗方法[10]。但是,肝硬化和门静脉高压症患者的胆道手术初步报告结果令人沮丧,一些系列并发症发生率和死亡率高达23%和25%[11-13]。这些不良后果主要是因为失血过多、肾功能衰竭、败血症和术后肝功能衰竭。由于这些不良因素的影响,人们对肝硬化患者行LC的安全担忧与日俱增。此外,人们还普遍认为微创手术的优势会被触觉反馈缺失[14]和立体视觉感缺失[15]带来的相关并发症风险抵消。而且门静脉高压症、凝血病和血小板减少症这些可能导致出血的相关因素,以及腹腔粘连和肝脏纤维化引起的顺应性降低都会损害腹腔镜下胆囊三角的暴露[16],进而带来更糟糕的结果。这就导致1992年美国国立卫生研究院发表共识称终末期肝病是LC的禁忌证[17]。
尽管如此,由于在微创手术和新手术器械的开发方面获得了更多的经验,LC还是逐渐应用于肝硬化患者中。20世纪90年代,关于肝硬化患者LC的研究结果首次发表[18,19],此后还报告了一系列病例揭示肝硬化患者行LC的良好效果。尽管如此,外科界尚未就肝硬化患者胆结石的最适当治疗方法达成一致意见。本综述的目的是总结肝硬化患者LC的当前发展趋势,重点关注患者的选择和技术策略以改善效果。
肝硬化患者外科手术的危险因素
接受非肝脏手术的肝硬化患者在文献中报告的可能死亡率高达45%[20]。从历史上看,外科医生通常不情愿为肝硬化患者手术,因为慢性肝功能衰竭有可能发展为急性,尤其是在麻醉和手术创伤影响下,使用较小肝毒性药物的方案减小了这种麻醉问题[21]。传统上与肝硬化患者并发症死亡率增加相关的因素包括:急诊手术,蔡尔德-皮尤评分C级、存在门脉高压、腹水、脑病、感染、贫血症、营养不良、黄疸、低白蛋白血症、低氧血症和不能通过维生素K,或者使用新鲜冷冻血浆输注来修正的凝血酶原时间异常[21,22]。肝硬化情况下行胆囊切除术的死亡率与潜在肝病的严重程度有关[23]。然而,一项大型对照研究多变量分析指出,三个能独立预测大手术死亡率的因素分别是年龄、美国麻醉医师协会身体状况分类和终末期肝病模型评分,特别是当评分高于8时[24]。另一项专门针对220名肝硬化患者的LC死亡率回顾性分析肯定了这三个相同的因素,终末期肝病模型评分的截止值为13[25],本研究仅包括蔡尔德-皮尤评分A和B级患者。另一项回顾性研究对94名接受LC的肝硬化患者的多因素分析发现,术中输注浓缩红细胞的次数增加,会增加30天内的死亡率[26]。
肝硬化患者与非肝硬化患者的LC
众所周知,肝硬化患者的胃肠手术难度和死亡发生率更高,肝硬化也是困难LC的主要原因[27]。事实上,肝硬化是与胆囊切除术后资源占用最相关的合并症之一[2]。一项从六个方面对比肝硬化和非肝硬化患者行LC的荟萃分析报告显示,中转开放手术的概率更高[7.06% vs 3.64%,P=0.0237,OR=2.008,95%CI:1.085–3.718];手术时间更长(98.2 vs 70分钟,P=0.00467,95%CI:8.93–47.47);术中出血增加(26.4% vs 3.1%,P=0.001,OR=11.226,95%CI:7.022–17.946);失血量增加(105.6 vs 35.2 mL);总体并发症增加(20.86% vs 7.99%,P=0.001,OR=3.034,95%CI:1.958–4.702)[28]。在伤口感染发生率和死亡方面没有统计学上的显著差异。住院时间分别为5.4天和3.5天[28]。值得注意的是,更多的肝硬化急性胆囊炎患者接受了急诊手术:47% vs 14.7%(P=0.001,OR=5.141,95%CI:3.363–7.861)。与择期手术相比,肝硬化患者的急诊手术与更高的并发症率、更长的术后住院时间和高7倍的死亡率相关[29],这能导致比较这两组时出现偏差。肝硬化患者LC总体数据比非肝硬化患者差,但不应把肝硬化患者使用微创手术排除在外。
LC与OC的对比
大多数关于肝硬化患者LC和OC的文献证据来自回顾性病例和回顾性对照研究。一些随机临床试验结果已经发表[30-33],是近期的两项荟萃分析[34,35]。一项系统评价确认了2 005名接受LC(n=1 756)和OC(n=249)的肝硬化患者[34]。资料显示,LC与OC相比,术后并发症更少(17.6% vs 47.7%),感染并发症更少(5.9% vs 19.9%),术后肝功能不全发生率(7.7% vs 18.1%)和死亡率更低(0.8% vs 2%)[34]。LC的中转率为5.8%,OC组因急性胆囊炎手术的患者较多(19.6% vs 28.8%)[34]。蔡尔德-皮尤评分A、B和C级患者的患病率相似,LC组分别为76.6%、21.77%和1.59%,OC组分别为67.2%、28.73% 和4.02%[34]。这些RCT的荟萃分析揭示了LC的以下优势:首先,术后并发症发生率总体较低(RR 0.52,95% CI:0.29–0.92;P=0.03)[35];其次,感染并发症的发生率较低(OR 0.23,95% CI:0.10–0.56,P=0.001)[34];第三,术后住院时间更短(平均差异:3.05天,95% CI:–4.09至–2.01天,P<0.001)[35];最后,LC术后恢复正常饮食的时间更短(平均差异-27.48 小时;95% CI:-30.96 至 -23.99;P<0.001)[35]。在手术时间、所需输血次数[35]和术后肝功能不全发生率[34]方面没有观察到统计学上的显著差异。由于缺乏这些随机对照研究中的数据,无法比较总体死亡率。另外,在一些大型病例系列[22,36](分别为226和265名患者)中发现的LC最常见并发症包括:术后腹水恶化(10.6%)、术中出血(5.2%)、腹腔积液(3.5%)、肺部感染(1.75%)、输血(1.1%)、胆囊次全切除术后残余胆囊结石复发(1.1%)和伤口感染(1.1%)。
另一项比较LC和OC的四个方面的荟萃分析[28]:腹腔镜组手术失血量较少(113 vs 425.2 mL,P=0.0154,95% CI:76.15–602.24);更短的手术时间(123.3 vs 150.2分钟,P=0.04173,95% CI:1.04-52.76)更短的住院时间(6 vs 12.2 天,P=0.001,95% CI:2.8-9.6)和无统计学意义的并发症率(9.52% vs 15%,P=0.5922),死亡率(4.76% vs 0%,P=0.99)及伤口感染率(0 vs 0.13%)。
重要的是我们注意到,这些数据大部分来自蔡尔德-皮尤评分A级和B级。Machado等人在一项大型系统回顾中,对1 310例肝硬化患者施行LC[37],仅有1.62%的患者为蔡尔德-皮尤评分C级,A级占78.75%,B级占19.5%。在Laurence等人的文献综述中,也分别只有LC 1.59%和OC 4.02%[34]。如上所述,施行LC的肝硬化患者的总体死亡率和死亡率很低,分别为0.45%和17%[37]。然而,在蔡尔德-皮尤评分C级中,个别报道的死亡率可能高达50%[25,38]。在Machado的报告(37例)里蔡尔德-皮尤评分等级为C、B和A级的死亡患者分别有17.1%、0.97%和0.12%。值得注意的是,我们发现在近年来的报道中LC和OC死亡率大大低于20世纪80年代报告的。这可能是由于更好的患者选择、重症监护的进步、更有效的肝衰竭治疗(包括肝移植),以及术前微创治疗的选择,例如,经皮胆囊造口术和经内窥镜逆行胰胆管造影术[34]。过去,很大一部分伴有黄疸的肝硬化患者接受了开放胆总管探查、引流术及OC。这些治疗通常没有作用,因为黄疸是由于慢性肝病失代偿而不是梗阻所致[39,40]。由于准确的成像方法,胆道内窥镜和经皮穿刺方法有效的干预,这种情况在当今几乎不存在了[41,42]。肝硬化治疗方法进步的另一个标志是20世纪80年代肝移植技术的改进,这彻底改变了肝功能衰竭和门静脉高压症的治疗。
文献中的另一个重要方面是大多数手术是择期性的。在随机临床对照研究中占96%[35],文献中的肝硬化患者总体LC为83%[37]。施行OC的患者似乎有更多的是急性胆囊炎[34],尽管没有统计证明。这一现象也存在于较久远的综述中,其中胆囊切除术的适应证为胆绞痛(54%)、急性胆囊炎(22%)、无症状胆结石(16%)、急性胰腺炎(5%)、非结石性胆囊炎(<1%),胆管炎(<1%)[28]。
肝硬化患者LC的总中转率为4.75%~5.8%[34,37]。中转的原因包括解剖结构不清、不受控制的出血、大量腹腔内粘连、需要进行胆总管探查和怀疑胆管损伤。最近证明MELD分数作为中转率的有效预测指标似乎是合理的,尤其是当分数高于14的时候[25,26]。中转开腹胆囊切除术始终是一种选择,尽管在初步腹腔镜手术中发生的并发症少的人会直观感觉并发症发生率比使用开放技术操作似乎更低。事实上,Chmielecki等人的一项基于人口的研究[43],对美国肝硬化患者2 857例LC和383例OC进行了分析,结果表明,中转的患者的感染、输血、肝衰竭率和再手术率与OC组相似。一种可能的解释是,LC期间进行的解剖可能有助于OC期间的进一步手术进程。直接开放手术可能是OC有较高的并发症发生率的直接因素[43]。应该着重强调的是,本研究中发现的中转率为14%[43],高于大多数报道[34,37]。当然,这一中转率还是与其他关于全国住院病人急性胆囊炎的研究结果11%相似[44]。有趣的是,这项研究显示出LC比OC有显著统计学意义的结果是更低的死亡率(1.3% vs 8.3%),更低的腹水形成(9.7% vs 18%),更低的肝衰竭率(7% vs 1.4%),更少的输血(7.4% vs 19.2%)、术后出血(3.9% vs 6.6%)和术后感染率(0.6% vs 3.5%) [43]。
蔡尔德-皮尤评分C级患者的特殊考虑
如前所述,专门针对蔡尔德-皮尤评分C级患者的文献很少,因为大多数研究主要由A级患者组成,在较小程度上由B级患者组成。正如预期的那样,与B级和C级患者相比,A级患者的手术时间、失血量、中转率和住院时间均减少[45]。C级代表肝硬化患者疾病的终末期;手术干预通常仅用于挽救生命。很少有C级患者被纳入文献报道的试验或研究,并且他们通常与B级患者相结合。在劳伦斯等人系统回顾中[34],根据蔡尔德-皮尤评分纳入1 194例接受LC的肝硬化患者,其中只有19例患者是C级。并且,当根据蔡尔德-皮尤评分分析死亡率的时候,6例死亡病例中4例为C级,其余两个分别是A和B级[34]。
C级患者的并发症发生率和死亡率可能分别高达75%和50%[38]。因此,一般建议不应在蔡尔德-皮尤评分C级肝硬化患者中尝试胆囊切除术,除非他们是对药物治疗无效的急性胆囊炎。这些患者应在非紧急情况下进行胆囊切除术之前进行内科治疗和降期。对于所有蔡尔德-皮尤评分B级和C级的肝硬化患者,术前咨询肝移植团队,在术后肝功能失代偿的情况下,将患者转诊至三级护理中心也是至关重要的[26]。在这种情况下,有肝移植指征的患者应在手术前列入排队名单,因为MELD分配系统能在肝功能恶化时挽救这些患者。由于缺乏数据,该人群中LC是否优于OC尚不清楚;然而,根据蔡尔德-皮尤评分A级和B级患者的结果,外科医生具有所需技能的情况下,微创手术更有优势。
在紧急情况下,对C级患者越来越普遍的做法是延迟胆囊切除术[46]。姚等人在对晚期肝硬化急性重症胆囊炎患者的回顾性研究中[47],在超声引导下经皮经肝行胆囊引流术(percutaneous transhepatic cholecystostomy,PTC)和延期LC显示出良好的效果。PTC的成功实施,胆囊内压力的迅速降低,很容易缓解症状。该研究包括29例肝硬化患者(6例A级,19例B级和4例C级)。平均引流治疗时间为8.1±1.4天,平均住院时间为15±7.2天。所有患者都接受了LC,没有中转。术后新鲜冷冻血浆输注(17.2%)、术后腹水增加(3.45%)和术后肝功能恶化(13.8%),他们都在2周内恢复到基线水平。因此,我们可以判断该研究中延迟LC的结果与前面的结果相似。PTC穿刺相关的出血并发症通过导管引流自行消退(5.6%),导管部位疼痛(37.9%)可以通过药物治疗。没有发生胆汁渗漏和导管移位。作者得出的结论是,PTC和延迟LC对于出现急性胆囊炎的晚期肝硬化患者是一种并发症最少且安全有效的手术[47]。类似的方法可以经胆囊管植入胆道支架引流[48]。
LC在肝硬化中的优势
与非肝硬化患者相比,肝硬化患者的腹腔镜手术具有一些额外的优势[49]。作为一种微创手术,它可确保更快恢复并提高患者对手术的耐受性。而且,对于手术团队来说更安全,因为很多肝硬化患者都感染了乙型和丙型肝炎病毒,术者与患者血液和内脏的接触较少。通过微小的通道进入腹腔减少了腹水从手术伤口渗漏的发生率和腹水感染的发生率,因为它减少了细菌播散和腹水污染。腹腔镜的图像放大可以识别扭曲和扩张的门静脉分支,以及充血的胆囊床,从而避免受伤和出血。此外,腹腔镜技术可减少腹壁创伤,保护腹壁侧支静脉,避免手术和术后的出血。气腹的正压也可减少出血。
LC也可以减少腹膜粘连,这使得后续干预更容易且创伤更小。这些患者中的一部分今后将有可能进行肝移植,这也是一个有价值的因素。
技术方面
CO2气腹可引起内脏缺血再灌注损伤,加重肝功能损害。这就是为什么它应该保持较低的压力并缓慢释放的原因[50]。
LC期间胆汁漏出比OC更常见(21% vs 31%),但与术后问题没有关系[51]。
出血难以控制是LC期间的一个主要问题,它是由腹部静脉曲张和继发于凝血因子合成抑制和血小板减少症的凝血障碍引起的。因此,可以在术前给予新鲜冷冻的血浆和血小板以及活化的重组因子Ⅶ(rFⅦa)[52]。
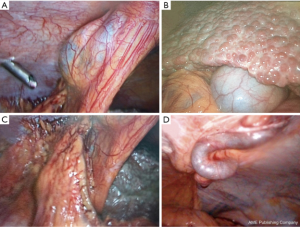
术前使用计算机断层扫描或磁共振成像检查很重要,因为它可以发现腹壁中的腹部静脉曲张和隐形肝癌[45]。保留脐旁静脉也很重要,因为它在门脉高压可以再通。脐旁静脉将部分血流从左门静脉分支分流到体循环,从而使门脉干中的血流保持通畅[53]。其通畅性对门脉压力有显著影响,可以减少食管静脉曲张出血的发生,但增加肝性脑病的发生[54]。而且,脐旁血管中断与术后门静脉血栓形成有关系[55]。第一个穿刺孔应在脐下方并使用开放法入腹,以避免损伤脐静脉和侧支静脉(图1)。
肝硬化患者LC期间遇到的主要困难可分为五项[37]:新生血管增多的粘连;肝脏难以回缩;胆囊肝三角区暴露不足;高危的胆囊床;高危的脐部。因此,推荐以下策略。
- 因脐静脉再通,脐部穿刺孔应远离镰状韧带,完全避开血管。
- 肝实质坚硬且纤维化,难以向头侧收缩。在胆囊体上牵拉,正好在壶腹部上方,以暴露胆囊三角。
- 将所有穿刺孔向靠右是有用的,因为当右肝叶明显萎缩时,肝门结构往往会向右侧扭曲。增加一个额外的穿刺孔可以看清脐部,保护肝左叶或十二指肠。在此孔位置放气有助于保持手术野清洁,并随时可以注入冲洗液以改善双极电凝效果。
- 如果这些操作仍不能正确暴露胆囊三角形,则应采用逆行法。
- 双极电刀在肝硬化患者的手术中很有用。它比单极电刀对胆囊床和肝实质的凝血效果更好。超声刀或能量平台也很有用,特别是用于分解粘连。氩束凝固和凝血酶喷雾也可用于止血。钝性解剖是基本操作。
- 当常规手术止血方法无法控制渗出时,可选择局部止血剂,如氧化纤维素或含有凝血酶和氨甲环酸的止血基质封闭剂。耐心才是至关重要的,因为中转不一定有助于控制这种凝血障碍引起的出血。
- 通常放置肝下引流管,因为术后可能出现凝血病渗出液。首选封闭式引流系统以避免腹水污染。引流管通常在24~48小时内拔除。
- 对肝脏进行腹腔镜穿刺活检以评估肝硬化的程度对肝病专家团队有帮助。
- 手术完成前,应检查所有穿刺孔是否有出血,关闭包括5 或 3 mm在内的所有穿刺孔,防止术后腹水漏出。
- 当胆囊床中有曲张的血管时,分离胆囊床很困难,可能导致大出血。在这种情况下,胆囊后壁可不予切除,仅去除黏膜或电灼破坏残留的黏膜。这种操作称为腹腔镜次全胆囊切除术(laparoscopic subtotal cholecystectomy,LSC)I型[36]。
- LSC的另一种变体,称为LSC II型,其尽可能靠近胆囊和胆囊管交界处的壶腹部切断,然后通过黏膜切除术或电灼破坏黏膜,并用电刀、超声刀或连续可吸收线缝合关闭残端。当由于肝门部复杂、炎症重、胆囊周围纤维化或胆囊肝三角解剖结构和脉管系统变异而导致肝门解剖困难时,都应采用该法。这些情况更多地与门静脉的变化有关。对于高危胆囊床和高危肝门的患者,应联合使用LSC I和II型,即可称为LSC III 型。
在Palanivelu 等人的报道里[36] ,265例接受LC的肝硬化患者中,77.7%使用了LSC。其中,53.6%的患者需要增加穿刺孔,8.3%的患者使用了LSC。大多数LSC为II型(38.5%),其次是I型(23.4%)和III型(15.95%)。该报道中的高LSC利用率导致低中转率(1%),但这与术后胆漏高(52.8%)有相关性。胆漏在LSC II 型(94.1%)的患者中最常见,其次是LSC I 型(38.1%)。事实上,通过腹腔镜或开放技术进行次全胆囊切除术的主要缺点是残端漏。然而,有报道称使用超声刀可以显著减少这种并发症[56]。
结论
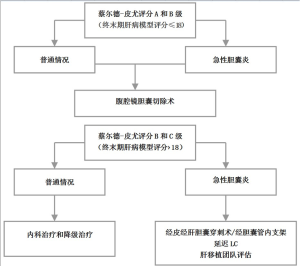
肝硬化患者的LC仍然是一项具有挑战性的手术,应该由具有LC和肝硬化患者围手术期管理经验的外科医生进行。肝硬化人群中发病率和死亡率的增加需要两个关键原则来实现LC的良好结果:严格选择患者和改进手术技术。对于择期和急诊胆囊切除术,对于MELD评分低于18的蔡尔德-皮尤评分A级和B级肝硬化,LC是最佳选择。另一方面,在择期情况下的C类患者不应进行手术治疗,而应该进行内科治疗和降级。在紧急情况下,应首先实施非手术临时措施,如PTC或经胆囊管内镜支架置入术,以减少局部炎症并改善临床状况,从而行延期LC更安全、更少并发症。另外,还应咨询肝移植团队。该处理办法如图2所示。
总之,1992年美国国立卫生研究院共识将肝病列为LC的禁忌证的决定无疑已不再适用于今天。有足够的文献证据可以安全地肯定肝硬化人群明显受益于微创技术,与开放手术相比取得了更好的结果,尤其是在术后感染、肝功能失代偿、术中输血、住院时间、术后腹水恶化、伤口感染、切口疝发生率和死亡率方面。
Acknowledgments
Funding: None.
Footnote
Provenance and Peer Review: This article was commissioned by the Guest Editor (Giovanni Battista Levi Sandri) for the series “Laparoscopic Liver Surgery” published in Annals of Laparoscopic and Endoscopic Surgery. The article has undergone external peer review.
Conflicts of Interest: All authors have completed the ICMJE uniform disclosure form (available at http://dx.doi.org/10.21037/ales.2017.01.08). The series “Laparoscopic Liver Surgery” was commissioned by the editorial office without any funding or sponsorship. The authors have no other conflicts of interest to declare.
Ethical Statement: The authors are accountable for all aspects of the work in ensuring that questions related to the accuracy or integrity of any part of the work are appropriately investigated and resolved.
Open Access Statement: This is an Open Access article distributed in accordance with the Creative Commons Attribution-NonCommercial-NoDerivs 4.0 International License (CC BY-NC-ND 4.0), which permits the non-commercial replication and distribution of the article with the strict proviso that no changes or edits are made and the original work is properly cited (including links to both the formal publication through the relevant DOI and the license). See: https://creativecommons.org/licenses/by-nc-nd/4.0/.
References
- Flum DR, Dellinger EP, Cheadle A, et al. Intraoperative cholangiography and risk of common bile duct injury during cholecystectomy. JAMA 2003;289:1639-44. [Crossref] [PubMed]
- Boehme J, McKinley S, Michael Brunt L, et al. Patient comorbidities increase postoperative resource utilization after laparoscopic and open cholecystectomy. Surg Endosc 2016;30:2217-30. [Crossref] [PubMed]
- de Goede B, Klitsie PJ, Lange JF, et al. Morbidity and mortality related to non-hepatic surgery in patients with liver cirrhosis: a systematic review. Best Pract Res Clin Gastroenterol 2012;26:47-59. [Crossref] [PubMed]
- Bloch RS, Allaben RD, Walt AJ. Cholecystectomy in patients with cirrhosis. A surgical challenge. Arch Surg 1985;120:669-72. [Crossref] [PubMed]
- Genzini T, de Miranda MP. Cholelithiasis in cirrhotic patients. (Analysis of cholelithiasis among patients with liver cirrhosis in São Paulo, Brazil). Arq Gastroenterol 1996;33:52-9. [PubMed]
- Bouchier IA. Post mortem study of the frequency of gall- stones in patients with cirrhosis of the liver. Gut 1969;10:705-10. [Crossref] [PubMed]
- Iber FL, Caruso G, Polepalle C, et al. Increasing prevalence of gallstones in male veterans with alcoholic cirrhosis. Am J Gastroenterol 1990;85:1593-6. [PubMed]
- Keus F, de Jong JA, Gooszen HG, et al. Laparoscopic versus open cholecystectomy for patients with symptomatic cholecystolithiasis. Cochrane Database Syst Rev 2006;CD006231 [PubMed]
- Angrisani L, Lorenzo M, Corcione F, et al. Gallstones in cirrhotics revisited by a laparoscopic view. J Laparoendosc Adv Surg Tech A 1997;7:213-20. [Crossref] [PubMed]
- Liguory C, Vitale GC. Biliary perestroika. Am J Surg 1990;160:237-8. [Crossref] [PubMed]
- Garrison RN, Cryer HM, Howard DA, et al. Clarification of risk factors for abdominal operations in patients with hepatic cirrhosis. Ann Surg 1984;199:648-55. [Crossref] [PubMed]
- Schwartz SI. Biliary tract surgery and cirrhosis: a critical combination. Surgery 1981;90:577-83. [PubMed]
- Aranha GV, Sontag SJ, Greenlee HB. Cholecystectomy in cirrhotic patients: a formidable operation. Am J Surg 1982;143:55-60. [Crossref] [PubMed]
- Salkini MW, Doarn CR, Kiehl N, et al. The role of haptic feedback in laparoscopic training using the LapMentor II. J Endourol 2010;24:99-102. [Crossref] [PubMed]
- Votanopoulos K, Brunicardi FC, Thornby J, et al. Impact of three-dimensional vision in laparoscopic training. World J Surg 2008;32:110-8. [Crossref] [PubMed]
- Lacy AM, Balaguer C, Andrade E, et al. Laparoscopic cholecystectomy in cirrhotic patients. Indication or contradiction? Surg Endosc 1995;9:407-8. [Crossref] [PubMed]
- Gallstones and laparoscopic cholecystectomy. NIH Consens Statement Online 1992;10:1-28. [PubMed]
- D'Albuquerque LA, de Miranda MP, Genzini T, et al. Laparoscopic cholecystectomy in cirrhotic patients. Surg Laparosc Endosc 1995;5:272-6. [PubMed]
- Yerdel MA, Tsuge H, Mimura H, et al. Laparoscopic cholecystectomy in cirrhotic patients: expanding indications. Surg Laparosc Endosc 1993;3:180-3. [PubMed]
- Demetriades D, Constantinou C, Salim A, et al. Liver cirrhosis in patients undergoing laparotomy for trauma: effect on outcomes. J Am Coll Surg 2004;199:538-42. [Crossref] [PubMed]
- Lopez-Delgado JC, Ballus J, Esteve F, et al. Outcomes of abdominal surgery in patients with liver cirrhosis. World J Gastroenterol 2016;22:2657-67. [Crossref] [PubMed]
- Yeh CN, Chen MF, Jan YY. Laparoscopic cholecystectomy in 226 cirrhotic patients. Experience of a single center in Taiwan. Surg Endosc 2002;16:1583-7. [Crossref] [PubMed]
- Mancero JM, D'Albuquerque LA, Gonzalez AM, et al. Laparoscopic cholecystectomy in cirrhotic patients with symptomatic cholelithiasis: a case-control study. World J Surg 2008;32:267-70. [Crossref] [PubMed]
- Teh SH, Nagorney DM, Stevens SR, et al. Risk factors for mortality after surgery in patients with cirrhosis. Gastroenterology 2007;132:1261-9. [Crossref] [PubMed]
- Delis S, Bakoyiannis A, Madariaga J, et al. Laparoscopic cholecystectomy in cirrhotic patients: the value of MELD score and Child-Pugh classification in predicting outcome. Surg Endosc 2010;24:407-12. [Crossref] [PubMed]
- Quillin RC 3rd, Burns JM, Pineda JA. Laparoscopic cholecystectomy in the cirrhotic patient: predictors of outcome. Surgery 2013;153:634-40. [Crossref] [PubMed]
- Iwashita Y, Ohyama T, Honda G, et al. What are the appropriate indicators of surgical difficulty during laparoscopic cholecystectomy? Results from a Japan-Korea-Taiwan multinational survey. J Hepatobiliary Pancreat Sci 2016;23:533-47. [Crossref] [PubMed]
- Puggioni A, Wong LL. A metaanalysis of laparoscopic cholecystectomy in patients with cirrhosis. J Am Coll Surg 2003;197:921-6. [Crossref] [PubMed]
- Carbonell AM, Wolfe LG, DeMaria EJ. Poor outcomes in cirrhosis-associated hernia repair: a nationwide cohort study of 32,033 patients. Hernia 2005;9:353-7. [Crossref] [PubMed]
- Lausten SB, Ibrahim TM, El-Sefi T, et al. Systemic and cell-mediated immune response after laparoscopic and open cholecystectomy in patients with chronic liver disease. A randomized, prospective study. Dig Surg 1999;16:471-7. [Crossref] [PubMed]
- Ji W, Li LT, Wang ZM, et al. A randomized controlled trial of laparoscopic versus open cholecystectomy in patients with cirrhotic portal hypertension. World J Gastroenterol 2005;11:2513-7. [Crossref] [PubMed]
- El-Awadi S, El-Nakeeb A, Youssef T, et al. Laparoscopic versus open cholecystectomy in cirrhotic patients: a prospective randomized study. Int J Surg 2009;7:66-9. [Crossref] [PubMed]
- Hamad MA, Thabet M, Badawy A, et al. Laparoscopic versus open cholecystectomy in patients with liver cirrhosis: a prospective, randomized study. J Laparoendosc Adv Surg Tech A 2010;20:405-9. [Crossref] [PubMed]
- Laurence JM, Tran PD, Richardson AJ, et al. Laparoscopic or open cholecystectomy in cirrhosis: a systematic review of outcomes and meta-analysis of randomized trials. HPB (Oxford) 2012;14:153-61. [Crossref] [PubMed]
- de Goede B, Klitsie PJ, Hagen SM, et al. Meta-analysis of laparoscopic versus open cholecystectomy for patients with liver cirrhosis and symptomatic cholecystolithiasis. Br J Surg 2013;100:209-16. [Crossref] [PubMed]
- Palanivelu C, Rajan PS, Jani K, et al. Laparoscopic cholecystectomy in cirrhotic patients: the role of subtotal cholecystectomy and its variants. J Am Coll Surg 2006;203:145-51. [Crossref] [PubMed]
- Machado NO. Laparoscopic Cholecystectomy in Cirrhotics. JSLS 2012;16:392-400. [Crossref] [PubMed]
- Currò G, Iapichino G, Melita G, et al. Laparoscopic cholecystectomy in Child-Pugh class C cirrhotic patients. JSLS 2005;9:311-5. [PubMed]
- Isozaki H, Okajima K, Morita S, et al. Surgery for cholelithiasis in cirrhotic patients. Surg Today 1993;23:504-8. [Crossref] [PubMed]
- Cryer HM, Howard DA, Garrison RN. Liver cirrhosis and biliary surgery: assessment of risk. South Med J 1985;78:138-41. [Crossref] [PubMed]
- Berman M, Nudelman IL, Fuko Z, et al. Percutaneous transhepatic cholecystostomy: effective treatment of acute cholecystitis in high risk patients. Isr Med Assoc J 2002;4:331-3. [PubMed]
- Itoi T, Wang HP. Endoscopic management of bile duct stones. Dig Endosc 2010;22:S69-75. [Crossref] [PubMed]
- Chmielecki DK, Hagopian EJ, Kuo YH, et al. Laparoscopic cholecystectomy is the preferred approach in cirrhosis: a nationwide, population-based study. HPB (Oxford) 2012;14:848-53. [Crossref] [PubMed]
- Csikesz NG, Tseng JF, Shah SA. Trends in surgical management for acute cholecystitis. Surgery 2008;144:283-9. [Crossref] [PubMed]
- Nguyen KT, Kitisin K, Steel J, et al. Cirrhosis is not a contraindication to laparoscopic cholecystectomy: results and practical recommendations. HPB (Oxford) 2011;13:192-7. [Crossref] [PubMed]
- Currò G, Cucinotta E. Percutaneous gall bladder aspiration as an alternative to laparoscopic cholecystectomy in Child-Pugh C cirrhotic patients with acute cholecystitis. Gut 2006;55:898-9. [Crossref] [PubMed]
- Yao Z, Hu K, Huang P, et al. Delayed laparoscopic cholecystectomy is safe and effective for acute severe calculous cholecystitis in patients with advanced cirrhosis: a single center experience. Gastroenterol Res Pract 2014;2014:178908.
- Shrestha R, Trouillot TE, Everson GT. Endoscopic stenting of the gallbladder for symptomatic gallbladder disease in patients with end-stage liver disease awaiting orthotopic liver transplantation. Liver Transpl Surg 1999;5:275-81. [Crossref] [PubMed]
- Lledó JB, Ibañez JC, Mayor LG, et al. Laparoscopic cholecystectomy and liver cirrhosis. Surg Laparosc Endosc Percutan Tech 2011;21:391-5. [Crossref] [PubMed]
- Ozmen MM, Kessaf Aslar A, Besler HT, et al. Does splanchnic ischemia occur during laparoscopic cholecystectomy? Surg Endosc 2002;16:468-71. [Crossref] [PubMed]
- Poggio JL, Rowland CM, Gores GJ, et al. A comparison of laparoscopic and open cholecystectomy in patients with compensated cirrhosis and symptomatic gallstone disease. Surgery 2000;127:405-11. [Crossref] [PubMed]
- Jeffers L, Chalasani N, Balart L, et al. Safety and efficacy of recombinant factor VIIa in patients with liver disease undergoing laparoscopic liver biopsy. Gastroenterology 2002;123:118-26. [Crossref] [PubMed]
- Widman A, de Oliveira IR, Speranzini MB, et al. Patent paraumbilical vein: hemodynamic importance in mansonic hepatosplenic portal hypertension (Study with ultrasonography Doppler. Arq Gastroenterol 2001;38:221-6. [PubMed]
- Gupta D, Chawla YK, Dhiman RK, et al. Clinical significance of patent paraumbilical vein in patients with liver cirrhosis. Dig Dis Sci 2000;45:1861-4. [Crossref] [PubMed]
- Andraus W, Pinheiro RS, Haddad LB, et al. The best approach for splenectomy in portal hypertension. Surgery 2011;149:853. [Crossref] [PubMed]
- Bessa SS, Abdel-Razek AH, Sharaan MA, et al. Laparoscopic cholecystectomy in cirrhotics: a prospective randomized study comparing the conventional diathermy and the harmonic scalpel for gallbladder dissection. J Laparoendosc Adv Surg Tech A 2011;21:1-5. [Crossref] [PubMed]

肖怀文
上海市浦东新区浦南医院普外科。从事普外科工作23年以来,先后在多所三甲医院及同济大学医学院不断学习普外科医疗及腹腔镜、内镜技术,师从上海多位高级专家,酷爱医学事业,熟练掌握普外医疗及科研技术。(更新时间:2021/8/15)
(本译文仅供学术交流,实际内容请以英文原文为准。)
Cite this article as: Pinheiro RS, Waisberg DR, Lai Q, Andraus W, Nacif LS, Rocha-Santos V, D’Albuquerque LAC. Laparoscopic cholecystectomy and cirrhosis: patient selection and technical considerations. Ann Laparosc Endosc Surg 2017;2:35.